Búcsú a májgyulladástól – egyelőre csak vagyonosoknak
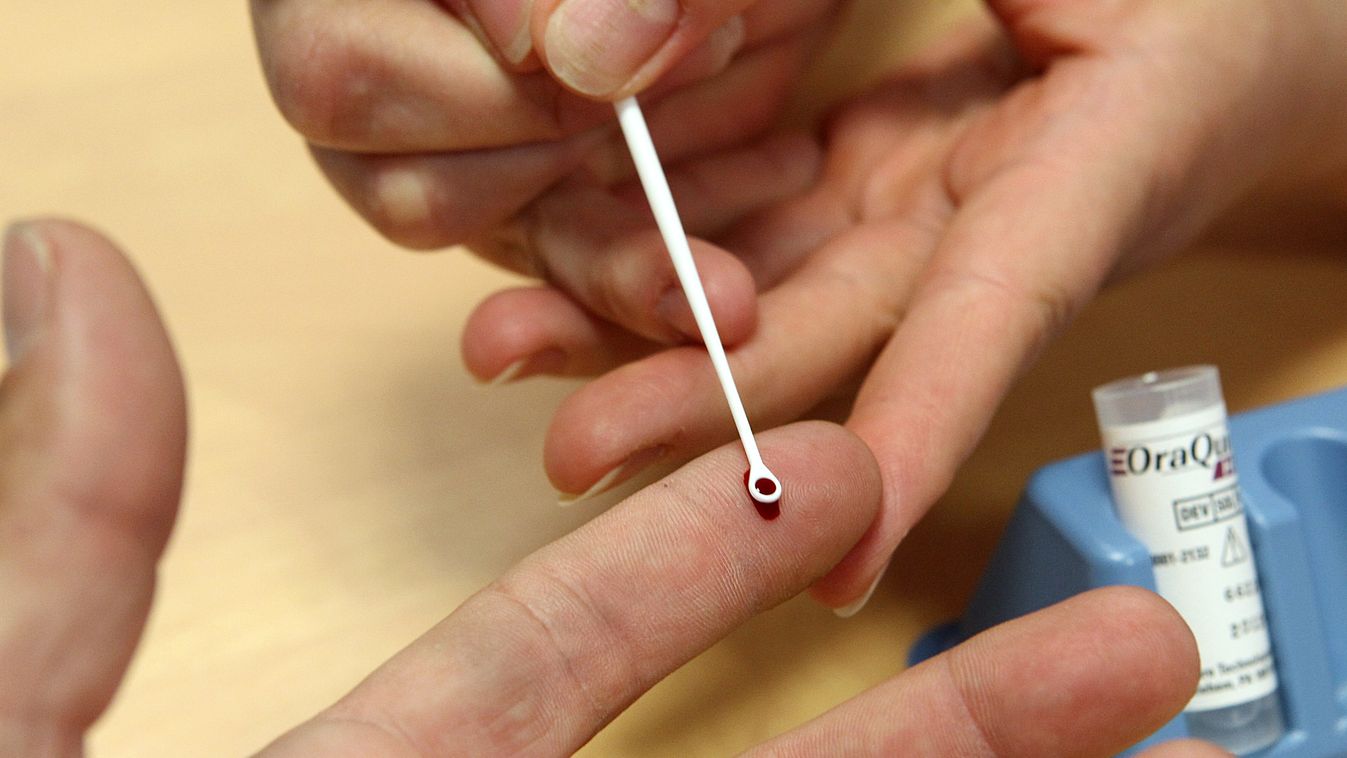

Évtizedek óta tartó erőfeszítések érhetnek révbe azzal a hepatitisz C elleni új kezeléssel, amelyre – ha minden a tervek szerint halad – az USA gyógyszerhatósága, az FDA még az idén áldását adja. Az új terápia a korábbi gyógyszereknél gyorsabban és kevesebb mellékhatással képes leküzdeni azt a krónikus májbetegséget, amely mintegy 170 millió embert sújt és évente 350 ezer áldozatot szed világszerte.
A csodaszerért azonban egyelőre olyan borsos árat kérnek, amelyet csak a legvagyonosabbak tudhatnak megfizetni. A terápia valójában két gyógyszer kombinációjából áll; ezek közül az egyik már a piacon van, adagonkénti 1000 dolláros árral, így csak ennek a beszerzése a teljes tizenkét hetes kezelésre számítva összesen 84 ezer dollárt (több mint 20 millió forintot) kóstál, és a kettős kombináció feltehetőleg még ennél is drágább lesz.
A kezelés várható költségei hallatán az orvosok, a betegjogi szervezetek és a betegbiztosítók egyhangúlag felháborodtak. Biztosra vehetjük, hogy az érintett felek az elkövetkező hónapokban éles szóváltások során fogják megvitatni, vajon a terápia megéri-e az árat, amit a gyártó elkér érte. Ugyanakkor afelől sincs kétség, hogy a kombináció hatékonysága minden eddigi kezelését felülmúlja, és kifejlesztéséhez igen komplex kémiai problémákat kellett áthidalni.
E nehézségek megértéséhez érdemes a hepatitisz C kutatásának történetét röviden áttekinteni. Maga a „hepatitisz” a májgyulladásra használt általános orvosi terminus; ezt az állapotot gyógyszerek, méreganyagok, túlzott alkoholfogyasztás és egyes fertőzések egyaránt kiválthatják. A „C” betű arra utal, hogy a specifikusan a májat támadó és károsító vírusok közül ezt a kórokozót fedezték fel harmadiknak.
Az 1970-es évek közepére már rendelkezésre álltak az A- és a B-típusú májgyulladás vírusait kimutató vértesztek. Az A típusú hepatitisz a fertőzött egyénekről étel vagy ital útján terjed, míg a B típusú rendszerint szexuális érintkezéssel, illetve vérrel – például közösen használt injekciós tű útján – adódik át.
Ám a kutatók rövidesen felismerték, hogy kell lennie egy harmadik típusú vírusos májgyulladásnak, amely addigra már lopva elterjedt az egész földgolyón, és az előbbieknél nagyobb valószínűséggel okozott tartós májkárosodást. A vírus azonosítására 1989-ben került sor, és az is hamar kiderült, hogy génjei szédítő sebességgel mutálódnak, minek folytán állandóan új, a fertőzésben egyformán sikeres vírusváltozatok – genotípusok – keletkeznek.
Ez a körülmény mindmáig megakadályozza a hatékony hepatitisz C-ellenes vakcina kidolgozását. Összevetésképpen: a hepatitisz B vírus evolúciója jóval lassabb, s vele szemben az 1980-as évek óta elérhető a védőoltás. A napokon belül tünetekkel jelentkező, mindig heveny lefolyású hepatitisz A ellen szintén védekezhetünk oltással.
Sokáig az interferon és a ribavirin kombinációja volt a hepatitisz C elleni egyetlen orvosság. A ribavirin a vírus szaporodását gátló vegyület, míg az interferon a szervezet természetes vírusellenes védekezésének kulcsfehérjéje, immunrendszerünk egyik leghatékonyabb fegyvere, melynek szintetikus változatát a kezelés során injekció formájában juttatják a keringésbe.
A kombináció a vírus genotípusától függően a betegek 25-75 százalékában bizonyult eredményesnek, miközben sok páciens elviselhetetlennek találta a súlyos influenzaszerű tünetektől és a fáradékonyságtól a depresszióig és a vérszegénységig terjedő mellékhatásait. Emellett a vírus gyakran ellenállóvá vált a kezeléssel szemben, így a beteg állapota a terápia ellenére is romlani kezdett.
A hatásosabb és tolerálhatóbb kezelések kifejlesztése érdekében jobban meg kellett ismerni a vírus külső burkát alkotó fehérjéket, és fel kellett tárni RNS-ból álló genetikai anyagának pontos szekvenciáját. Ez a kutatók ezreinek feladatot adó munka az 1990-es évek java részét felemésztette, de eredményeképpen sikerült egy ígéretes gyógyszer-támadáspontot azonosítani: a vírus másolódásához szükséges egyik enzim, a virális proteáz gátlása komoly sikerrel kecsegtetett.
Két gyógyszercég, a Vertex Pharmaceuticals és az azóta a Merck-kel összeolvadt Schering-Plough nagyjából egyszerre rukkolt ki a maga proteáz-gátlószerével: az előbbit telaprevirnek, az utóbbit boceprevirnek keresztelték. Klinikai kísérletek igazolták, hogy a hagyományos kezelés – ribavirin és interferon – mellett a két új szert is kapó betegek 60-75 százalékában a kimutatható szint alá csökkent a vérben keringő vírus mennyisége. Ugyanezt az eredményt a hagyományos kombinációval csak a betegek legfeljebb 44 százalékában sikerült elérni.
Az FDA 2011-ben engedélyezte is a két új gyógyszert, de az orvosi körökben sokak által megélt diadal érzése hamar csalódottságnak adta át a helyét. Kiderült ugyanis, hogy az új szerek mellékhatásai szintén elég riasztóak, ráadásul csak egy meghatározott vírusváltozattal, az 1-es genotípussal szemben képesek fellépni.
Bár Kanadában és az USA-ban tényleg ez a leggyakoribb genotípus, a világnak azon a tájain, ahol a hepatitisz C népbetegségnek számít, kifejezetten ritka. Az interferon és a ribavirin pedig – a maguk szintén nem elhanyagolható mellékhatásaival együtt – továbbra is összetevői maradtak a kezelésnek, ami tovább csökkentette a kiterjesztett kombináció vonzerejét.
A telaprevir és boceprevir iránti lelkesedés elültével újabb, ígéretes célpontnak mutatkozó vírusfehérjék tűntek fel a láthatáron. A tudósok azonban eddigre megtanulták a leckét, hogy egy virális enzim vagy fehérje kiiktatása önmagában sosem elegendő: a hepatitisz C megfékezéséhez a vírus genetikai állományának másolódását is célkeresztbe kell venni.
A kínzó mellékhatások kiküszöbölése pedig – ismerték fel a fejlesztők – csak úgy lehetséges, ha a gyógyszer minél gyorsabban és közvetlenebbül, a lehető legtöbb szerv megkerülésével éri el a májat.
A Pharmasset nevű cég a 2000-es évek közepétől fogva a nukleotid-analógok vegyületcsoportjában keresgélt a fenti szempontoknak leginkább megfelelő gyógyszerjelölt után. Ezek a molekulák hasonlítanak a DNS és az RNS alkotórészeire, ezért a vírus a saját RNS-e másolásakor felhasználja őket, ám oda beépülve megakadályozzák a másolás folytatását. Csakhogy e felismeréstől még hosszú és rögös út vezetett a gyógyszerként szóba jöhető származékok kidolgozásáig.
A nukleotid-analógok módosítatlan formájukban nem jutnak át a bél falán, így nem szívódnak fel a vérbe sem, hogy a vérárammal eljussanak a májba. Azt a keveset pedig, ami mégis odatalál, a máj enzimei pillanatok alatt hatástalanítják. Michael Sofia, a Pharmasset vegyésze rájött, hogy a nukleotid-analógok megfelelő kémiai átalakítása valamennyi problémát egyszerre megoldja.
A módosítatlan nukleotid-analógok kettős negatív töltésű savas motívumot, foszfátcsoportot viselnek, ami vízoldékonysága és erős töltése miatt hátráltatja a bélfalon való átjutást, illetve áldozatul esik a máj bontóenzimeinek. A foszfátcsoport észteres módosítása lefedte a negatív töltéseket, zsíroldékonnyá – s ezzel a bélfalon könnyen áthatolóvá – alakította a vegyületeket, és a máj bontóenzimeit is lefegyverezte. Az észteresített nukleotid-származékot Sofia tiszteletére sofosbuvirnak nevezték el, a Pharmassetért pedig 2011-ben nem kevesebb, mint 11 milliárd dollárt pengetett ki a farma-óriás Gilead.
Egy nagyszabású klinikai tanulmányban a ribavirin és interferon mellett sofosbuvirral kezelt 327 beteg közül 295-nek teljesen eltűntek a véréből a vírusrészecskék a 12 hetes kezelési periódus végeztével.
Egy ezt követő kísérletben pedig beigazolódott, hogy a 12 hetes sofosbuvir-ribavirin kombinált kezelés ugyanolyan eredményes, mint a 24 hetes interferon-ribavirin, és az interferon nélküli kísérleti ágon kevesebb betegnél alakult ki súlyos mellékhatás, például láz vagy depresszió. Ennek nyomán az FDA 2013-ban törzskönyvezte a sofosbuvir és ribavirin kombinációját a hepatitisz C kezelésére.
A kutatók azonban még ekkor sem érezték úgy, hogy eljött volna a pihenés ideje. Míg a sofosbuvir fejlesztés alatt állt, különböző vírusfehérjéket gátló további vegyületeket kerestek abban a reményben, hogy valamelyikük végre egyszer és mindenkorra kiválthatja az interferont és a ribavirint. E szerek egyikét, a Bristol-Myers Squibb által fejlesztett daclatasvirt azon frissiben ki is próbálták a sofosbuvirral kombinálva.
Az eredmény mindenkit lenyűgözött: a duó csaknem valamennyi beteget meggyógyította, méghozzá a korábbiaknál lényegesen kevesebb mellékhatással. Azóta a Gilead még három tanulmányt folytatott le, amelyekben a sofosbuvirt egy másik szerrel, a ledipasvirrel párosították. Ez a kombináció az 1-es genotípusú vírus által megtámadott betegek legalább 94 százalékát meggyógyította.
A sofosbuvir és a ledipasvir egyetlen, napi egyszer szedendő tablettába keverve az FDA jóváhagyására vár, s a hatósági ámen elemzők szerint még az idén meg is érkezik. Ha így lesz, kétségkívül új korszak nyílik a C-típusú hepatitiszből végleges gyógyulást remélő milliók számára. A többi genotípus ellen is hatékony hasonló szerek fejlesztése szintén a célegyenesbe érkezett.
Mivel a hamarosan piacra kerülő kombinált tabletta mindössze tizenkét hét alatt meggyógyítja a hepatitisz C-t, a kezelés végeredményben kevesebbe kerülhet, mint az egyébként krónikus betegség élethosszig való kúrálgatása. (Addig, amíg a Gilead nem hozza nyilvánosságra a fogyasztói árat – márpedig ezt csak az FDA-engedély kiadása után tervezi megtenni –, az új kezelés költségeit csak becsülni lehet.)
De pusztán attól, hogy a tizenkét hetes gyógyszerkúra olcsóbb lesz, mint a krónikus ellátás, a betegek többsége számára még mindig elérhetetlen marad. David Thomas, a Johns Hopkins Egyetem fertőző betegségekkel foglalkozó tanszékének vezetője szerint az új szer egyelőre az ára miatt nem válhat globális egészségügyi léptékű megoldássá. „Egy olyan kezelés, ami több mint 100 ezer dollárba kerül, nem sokat változtat majd az oroszországi börtönlakók vagy a pakisztáni kábítószeresek helyzetén” – jelezte.
Az összeg megizzasztja a biztosítótársaságokat is: „Sosem volt dolgunk ennyire drága szerrel, amely ilyen sok embert érintett volna” – hangoztatta egy több mint 3500 biztosító képviseletében nyilatkozó szóvivő. – „Egy kisebb társaság gyógyszer-ráfordításának jelentős részét felemésztheti egyetlen hepatitisz C-s beteg kezelése.”
A gyártó ugyanakkor azt hangsúlyozza, hogy senki sem fog az anyagi helyzete miatt elesni a kezeléstől. Ahogy azt az általa előállított HIV-gyógyszerekkel is teszi, a Gilead célzott támogatást fog nyújtani az USA-beli betegeknek, megfelelő jogdíj fejében kiadja majd a licencet az USA-n kívüli generikus gyártóknak, és a szegényebb országok számára nyomott árakat biztosít. Egyiptomban, ahol a világon a legmagasabb a hepatitisz C előfordulása, a 28 napi sofosbuvir-adag például az USA-ban fizetendő ár törtrészébe, mindőssze 300 dollárba kerül.











